- Quelle est la composition de l'air ?Quelles sont les valeurs de A, B et C?

- A= 0,1 ( 0 ) , B=21 ( 20 ) et C= 78 ( 80 ).
- A= 1 ( 0 ) , B=21 ( 20 ) et C= 78 ( 80 ).
- A= 1 ( 0 ) , B=78 ( 80 ) et C= 21 ( 20 ).
- Dans un volume de 100L d'air, le volume de dioxygène ( O2 ) est :
- un ciquième du volume de l'air soit : 20L = ( 100 / 5 ).
- quatre ciquièmes du volume de l'air soit : 80L = ( 4 x100 / 5 ).
- un ciquième du volume de l'air soit :10L = ( 100 / 5 ).
- Dans un volume de 100L d'air, le volume de diazote ( N2 ) est :
- un ciquième du volume de l'air soit : 20L = ( 100 / 5 ).
- quatre ciquièmes du volume de l'air soit : 80L = ( 4 x100 / 5 ).
- un ciquième du volume de l'air soit : 10L = ( 100 / 5 ).
- Notre salle de sciences physiques a une longueur L = 12m , une largeur l = 6 m et une hauteur h = 4m.
Le volume V = L x l x h, sachant que 1mètre cube = 1000L.
Quel est le volume de dioxygène contenu dans la salle ?- V = 288 m3 = 28800L, soit V ( O2 ) =5760L.
- V = 288 m3 = 288000L, soit V ( O2 ) =57600L.
- V = 288 m3 = 2880L, soit V ( O2 ) =576L.
- On suppose que le volume de la salle de sciences physiques est V =300000 L.
Le volume de dioxygène est V ( O2 ) = ( 300000 x 20/100 ) = 60000 L.
La classe est occupée par 25 personnes qui utilisent 2L de dioxygène par minute.
Au bout de combien de temps , tout le dioxygène sera consommé ?- Par minute on consomme 25x2 =50L, 60000/50 = 1200 min = 20h.
- Par minute on consomme 25x2 =50L, 60000/50 = 120 min = 2h.
- Par minute on consomme 25x2 =50L, 60000/50 = 1200 min = 200h.
- Quand le piston passe de la position A à la position B, le volume de l'air a :

- diminué, le volume occupé par l'air a diminué, nous avons réalisé une compression et le pouce est attiré.
- augmenté, le volume occupé par l'air a diminué, nous avons réalisé une compression et le pouce est repoussé.
- diminué, le volume occupé par l'air a diminué, nous avons réalisé une compression et le pouce est repoussé.
- Quand le piston passe de la position A à la position B, le volume de l'air a :
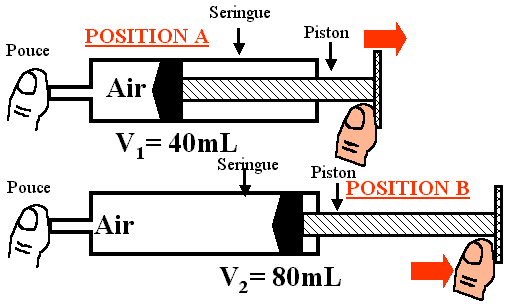
- augmenté, le volume occupé par l'air a augmenté, nous avons réalisé une détente ou expansion et le pouce est attiré.
- augmenté, le volume occupé par l'air a diminué, nous avons réalisé une compression et le pouce est repoussé.
- augmenté, le volume occupé par l'air a augmenté, nous avons réalisé une détente ou expansion et le pouce est repoussé.
- Dans le système international (S.I), l'unité de la pression atmosphérique est :
- Le Pascal ( Pa ) , elle se mesure avec un baromètre.
- Le Pascal ( Pa ) , elle se mesure avec un thermomètre.
- L'hectoPascal ( hPa ) , elle se mesure avec un baromètre.
- Un hectoPascal 1hPa =
- 10 Pa
- 1000Pa
- 100Pa
- En météorologie marine, on utilise le bar; 1 bar = 1013 hPa.
Quelle est la valeur de 1,013hPa en bar ?- 1,013hPa = 1mbar ( millibar).
- 1,013hPa = 10mbar ( millibar).
- 1,013hPa = 0,1mbar ( millibar).
- Comparaison entre la pression de gonflage d'une voiture et d'un VTT ( adulte ).
- Pneu d'une voiture de 2 à 2,5 bar et pour vététiste de 3,5 à 4 bar .
- Pneu d'une voiture de 5 à 6,5 bar et pour vététiste de 3,5 à 4 bar .
- Pneu d'une voiture de 2 à 2,5 bar et pour vététiste de 1 à 1,5 bar .
- La pression de gonflage d'un VTT dépend de plusieurs critères :
la section du pneu, les spécifications du constructeur, la masse en kg du vététiste, le terrain et l'utilisation.
La pression s'exprime en bar ou en PSI. 1 PSI = 0,07 bar ou 1bar = 14,5 PSI.
La pression recommandée par le constructeur est généralement indiquée en PSI. Elle est- de 2 à 2,5 bar pour vététiste "léger" (<70kg) et de 3,5 à 4 bar pour " gros " ( >70kg).
- de 1 à 1,5 bar pour vététiste "léger" (<70kg) et de 3,5 à 4 bar pour " gros " ( >70kg).
- de 2 à 2,5 bar pour vététiste "léger" (<70kg) et de 6,5 à 7 bar pour " gros " ( >70kg).
- Un litre d'air dans les conditions normales de pression ( p =1013hPa ) et de température (25°C) pèse:
- 13 mg ou 1,3g ou 0,0013 kg.
- 1,3 mg ou 13g ou 0,013 kg.
- 1,3 g ou 13mg ou 0,00013 kg.
- La masse d'une citerne en plastique de 20 Litres pèse 30,026kg.
On introduit 100L d'air comprimé, quel sera le volume d'air contenu dans la citerne?
Quelle sera la masse de la citerne ?- Le volume d'air est 120L et la masse est 30,026 kg + 0,13kg =30,156kg.
- Le volume d'air est 100L et la masse est 30,026 kg + 0,13kg =30,156kg.
- Le volume d'air est 120L et la masse est 30,026 kg + 130g =160,026kg.
- La masse d'une citerne en plastique de 20 Litres pèse 30,026kg.
On introduit 20L d'eau . Quelle sera la masse totale de la citerne?( 1L d'eau pèse 1kg ).
Quelle sera la masse de la citerne ?- La masse de l'eau est 20x1=20kg, la masse totale est 20+30,026 = 50,026kg.
- La masse de l'eau est 20x1=20kg, la masse totale est 20+30 = 50kg.
- Dans chaque bouteille, on a introduit un certain nombre de molécules d'air.
Quel est le nombre respectif de molécules dans chaque bouteille ?
Comparer la pression de l'air dans chaque bouteille.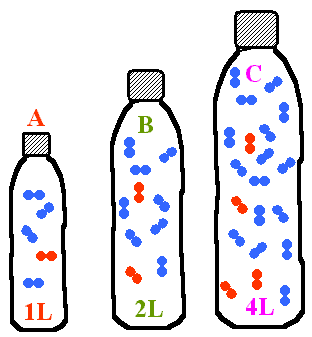
- A: 1 molécule d'air, B: 2 molécules d'air , C: 4 molécules d'air. Comme le volume double à chaque fois et le nombre de molécule aussi, la pression est la même.
- A: 1 molécule d'air, B: 2 molécules d'air , C: 4 molécules d'air. Comme le volume double à chaque fois et le nombre de molécule aussi, la pression augmente.
- A: 1 molécule d'air, B: 2 molécules d'air , C: 4 molécules d'air. Comme le volume double à chaque fois et le nombre de molécule aussi, la pression diminue.
- Dans chaque bouteille, on a introduit un certain nombre de molécules d'air.
Quel est le nombre respectif de molécules dans chaque bouteille ?
Comparer la pression de l'air dans chaque bouteille.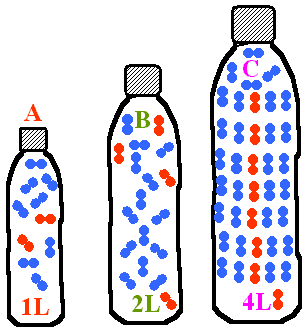
- A: 2 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Comme le quotient du nombre de molécule sur le volume est: A: 2, B: 2 et C: 2 , la pression est la même partout.
- A: 2 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Comme le quotient du nombre de molécule sur le volume est: A: 2, B: 2 et C: 2 , la pression diminue de A vers C.
- A: 2 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Comme le quotient du nombre de molécule sur le volume est: A: 2, B: 2 et C: 2 , la pression augmente de A vers C.
- Dans chaque bouteille, on a introduit un certain nombre de molécules d'air.
Quel est le nombre respectif de molécules dans chaque bouteille?
Classez les bouteilles de la pression la plus grande à la plus petite.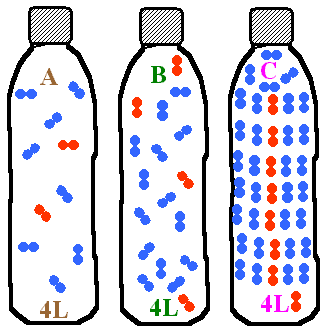
- A: 2 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Bouteille C , puis B et enfin A.
- A: 2 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Bouteille A , puis B et enfin C.
- A: 2 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Bouteille C , puis A et enfin B.
- Dans chaque bouteille, on a introduit un certain nombre de molécules d'air.
Quel est le nombre respectif de molécules dans chaque bouteille ?
Comparer la pression de l'air dans chaque bouteille.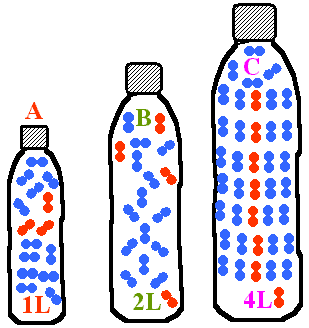
- A: 3 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Comme le quotient du nombre de molécule sur le volume est: A: 3, B: 2 et C: 2 , la pression la plus forte est en A , B et C ont la même pression.
- A: 3 molécules d'air, B: 4 molécules d'air , C: 8 molécules d'air. Comme le quotient du nombre de molécule sur le volume est: A: 3, B: 2 et C: 2 , la pression la moins forte est en A , B et C ont la même pression.
- Quelle est l'affirmation correcte ?
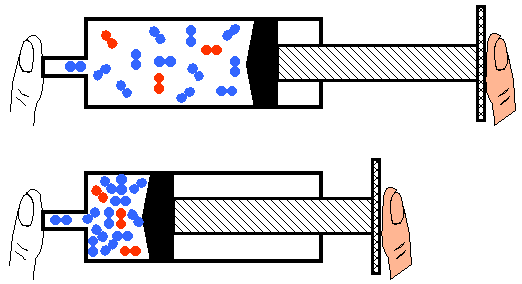
- Il ya 3molécules d'air ou 3 molécules de O2 et 12 molécules de N2. Dans la seringue du haut l'air est comprimé et dans la seringue du bas l'air est expansé.
- Il ya 3molécules d'air ou 3 molécules de O2 et 12 molécules de N2. Dans la seringue du haut l'air est détendu et dans la seringue du bas l'air est comprimé.
- Il ya 15 molécules d'air ou 3 molécules de O2 et 12 molécules de N2. Dans la seringue du haut l'air est détendu et dans la seringue du bas l'air est comprimé.