II) Energie chimique & pile électrochimique.
- Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?

- Le multimètre est branché en voltmètre, les deux fils de connexion sont inversés.La lame de cuivre est la borne positive.La lame de zinc est la borne négative. C'est le début de l'expérimentation car la transformation chimique n'a pas encore commencé, on ne voit pas encore de dépôt de cuivre.
- Le multimètre est branché en ampèremètre, les deux fils de connexion sont inversés.La lame de cuivre est la borne négative .La lame de zinc est la borne positive. C'est le début de l'expérimentation car la transformation chimique n'a pas encore commencé, on ne voit pas encore de dépôt de cuivre.
- Le multimètre est branché en voltmètre, les deux fils de connexion sont inversés.La lame de cuivre est la borne négative .La lame de zinc est la borne positive. C'est le début de l'expérimentation car la transformation chimique n'a pas encore commencé, on ne voit pas encore de dépôt de cuivre.
- Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?

- Le multimètre est branché en voltmètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc gagne des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile s'arrêtera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne négative, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?

- L'énergie libérée par les réactifs lors de cette transformation est transformée en énergie thermique ( la température augmente ), en énergie électrique , il appraît une intensité de courant qui passe de la lame de cuivre vers la lame de zinc et une énergie des produits de la réaction. Le mouvement d'ensemble des électrons va de la lame de zinc vers la lame de cuivre.
- L'énergie libérée par les réactifs lors de cette transformation est transformée en énergie thermique ( la température diminue ), en énergie électrique , il appraît une intensité de courant qui passe de la lame de cuivre vers la lame de zinc et une énergie des produits de la réaction. Le mouvement d'ensemble des électrons va de la lame de cuivre vers la lame de zinc.
- L'énergie libérée par les réactifs lors de cette transformation est transformée en énergie thermique ( la température augmente ), en énergie électrique , il appraît une intensité de courant qui passe de la lame de zinc vers la lame de cuivre et une énergie des produits de la réaction. Le mouvement d'ensemble des électrons va de la lame de zinc vers la lame de cuivre.
- En construction. Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?
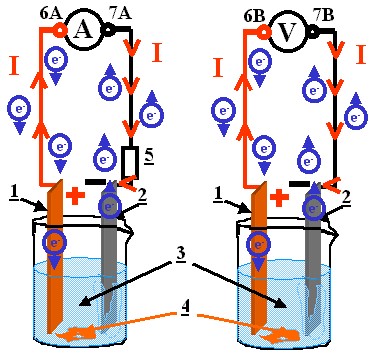
- Le multimètre est branché en voltmètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc gagne des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile s'arrêtera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne négative, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- En construction. Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?

- Le multimètre est branché en voltmètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc gagne des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile s'arrêtera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne négative, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?

- Le multimètre est branché en voltmètre, les deux fils de connexion sont inversés.La lame de cuivre est la borne positive.La lame de zinc est la borne négative. C'est le début de l'expérimentation car la transformation chimique n'a pas encore commencé, on ne voit pas encore de dépôt de cuivre.
- Le multimètre est branché en ampèremètre, les deux fils de connexion sont inversés.La lame de cuivre est la borne négative .La lame de zinc est la borne positive. C'est le début de l'expérimentation car la transformation chimique n'a pas encore commencé, on ne voit pas encore de dépôt de cuivre.
- Le multimètre est branché en voltmètre, les deux fils de connexion sont inversés.La lame de cuivre est la borne négative .La lame de zinc est la borne positive. C'est le début de l'expérimentation car la transformation chimique n'a pas encore commencé, on ne voit pas encore de dépôt de cuivre.
Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?
- Le multimètre est branché en voltmètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc gagne des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile s'arrêtera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne négative, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?
- L'énergie libérée par les réactifs lors de cette transformation est transformée en énergie thermique ( la température augmente ), en énergie électrique , il appraît une intensité de courant qui passe de la lame de cuivre vers la lame de zinc et une énergie des produits de la réaction. Le mouvement d'ensemble des électrons va de la lame de zinc vers la lame de cuivre.
- L'énergie libérée par les réactifs lors de cette transformation est transformée en énergie thermique ( la température diminue ), en énergie électrique , il appraît une intensité de courant qui passe de la lame de cuivre vers la lame de zinc et une énergie des produits de la réaction. Le mouvement d'ensemble des électrons va de la lame de cuivre vers la lame de zinc.
- L'énergie libérée par les réactifs lors de cette transformation est transformée en énergie thermique ( la température augmente ), en énergie électrique , il appraît une intensité de courant qui passe de la lame de zinc vers la lame de cuivre et une énergie des produits de la réaction. Le mouvement d'ensemble des électrons va de la lame de zinc vers la lame de cuivre.
En construction. Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?
- Le multimètre est branché en voltmètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc gagne des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile s'arrêtera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne négative, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
En construction. Le montage ci-dessous représente une pile électrochimique. Quelle est la bonne proposition?
- Le multimètre est branché en voltmètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc gagne des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne positive, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile s'arrêtera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.
- Le multimètre est branché en ampèremètre.La lame de cuivre est la borne négative, les électrons sont "attirés" par les ions Cu2+ et forment le dépôt du cuivre. La solution va perdre sa coloration bleue.La lame de zinc est la borne négative: le zinc perd des électrons et se transforme en ions Zn2+.Au bout d'un certaine durée le zinc disparaît et la pile continuera de fonctionner. La transformation chimique a commencé, on voit le dépôt de cuivre.